به گزارش بخش علمی رسانه اخبار فناوری تک فاکس،
دانشمندان در جهان اول ، چگونگی برنامه ریزی مجدد سلول ها برای مبارزه-و به طور بالقوه معکوس-بیماری های مغزی مانند آلزایمر را درک کرده اند.
محققان دانشگاه کالیفرنیا ، ایروین سلولهای ایمنی آزمایشگاهی را ایجاد کردند که می توانند ساخت مغز سمی را ردیابی کرده و آن را از بین ببرند ، حافظه و عملکرد مغز را در موش ها بازیابی کنند.
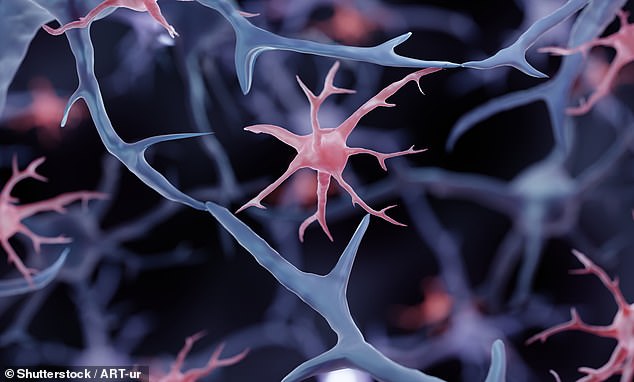
آنها این کار را با تبدیل سلول های بنیادی – که می توانند به هر سلول در بدن تبدیل شوند – به سلولهای ایمنی مغز به نام میکروگلیا انجام دادند.
سلولهای ویرایش شده قادر به پاکسازی آشغال ها بدون آسیب رساندن به بافت سالم بودند و منجر به کاهش التهاب و بهبود چشمگیر در عملکرد مغز در موش ها شدند.
این درمان می تواند شروع یک رویکرد کاملاً جدید در مورد بیماری عصبی – با کاربردهای بالقوه برای سرطان مغز ، مولتیپل اسکلروز و موارد دیگر باشد.
براساس انجمن آلزایمر ، نزدیک به 7 میلیون آمریکایی امروز با آلزایمر زندگی می کنند. درمان های فعلی فقط می توانند علائم را کند کنند – آنها را معکوس نکنید.
محاکمات انسانی هنوز چندین سال مرخصی است ، اما نتایج اولیه دانشمندان را وزوز می کند.
این تیم گفت که اگر این درمان در افرادی مانند موش ها انجام شود ، می تواند آینده سلامت مغز را بازنویسی کند.
محققان با تبدیل سلولهای بنیادی به سلولهای ایمنی به نام میکروگلیا ، این روش درمانی جدید را توسعه دادند (تصویر)
نتایج حاکی از آن است که محققان بر یکی از بزرگترین موانع معالجه بیماری های دژنراتیو مغز غلبه کرده اند: گرفتن دارو از سد خونی مغزی.
این لایه محافظ سلولها سطوح داخلی رگهای خونی را در مغز خط می کند و به عنوان نوعی دروازه عمل می کند و مواد مضر را در خارج نگه می دارد و مواد مفید را در آن نگه می دارد.
درمان های سنتی مبتنی بر سلول نتوانسته اند این سد را دور بزنند ، اما میکروگلیا لازم نیست زیرا آنها قبلاً در مغز حضور دارند.
همکار و استاد عصب شناسی ماتئو بلورتون-جونز در بیانیه ای گفت: “ما یک سیستم تحویل زندگی قابل برنامه ریزی و قابل برنامه ریزی ایجاد کرده ایم که با سکونت در مغز خود و پاسخ دادن به تنها زمان و جایی که لازم است ، این مشکل را به وجود می آورد.”
میکروگلیای معمولی هم به پیشرفت بیماری آلزایمر کمک می کند و هم صدمه می زند. هنگامی که پلاک شروع به ساخت در مغز می کند ، آنها به عمل می آیند و آنزیم ها را آزاد می کنند تا آن را تجزیه کنند.
اما با گذشت زمان ، آنها شروع به اجرای Amok می کنند و باعث التهاب و آسیب رساندن به سلولهای عصبی می شوند.
Blurton-Jones و همکارانش راهی برای ایجاد میکروگلیا پیدا کردند که بدون اینکه آن را بدتر کند ، آسیب مغزی را درمان می کند.
ابتدا ، آنها میکروگلیای انسانی را از سلولهای بنیادی رشد می دهند ، سپس از ویرایش ژن CRISPR استفاده می کنند – تکنیکی که به دانشمندان اجازه می دهد تغییرات دقیقی را در DNA سلول ایجاد کنند – برای برنامه ریزی مجدد نحوه عملکرد آنها.

میکروگلیای اصلاح شده ، پلاک های مغز را کاهش داد (در تصویر نارنجی) بدون آسیب رساندن به نورون ها و سیناپس ها (تصویر به رنگ سبز)

پلاک ها با دخالت در سیگنالینگ سلولی عملکرد طبیعی مغز را مختل می کنند ، بنابراین باعث کاهش شناختی می شوند
میکروگلیای اصلاح شده Neprilysin ، آنزیمی را که پلاک مغز را تجزیه می کند ، ترشح می کند ، تنها در حالی که در واقع در نزدیکی یک پلاک قرار دارند. این امر مانع از آسیب رساندن به قسمتهای مهم و سالم مغز می شود.
پلاک ها با دخالت در سیگنالینگ سلولی عملکرد طبیعی مغز را مختل می کنند ، بنابراین باعث کاهش شناختی می شوند.
ژان پل چادارویان ، محقق فوق دکترا در آزمایشگاه Blurton-Jones گفت: “از آنجا که پروتئین درمانی فقط در پاسخ به پلاک های آمیلوئید تولید می شد ، این رویکرد بسیار هدفمند و در عین حال کاملاً مؤثر بود.”
رابرت اسپیتال ، نویسنده و استاد علوم دارویی گفت: “این کار درهای کلاس کاملاً جدیدی از درمان های مغز را باز می کند.”
“به جای استفاده از داروهای مصنوعی یا بردارهای ویروسی ، ما در حال ثبت نام سلولهای ایمنی مغز به عنوان وسایل نقلیه تحویل دقیق هستیم.”
این روش درمانی جدید می تواند به بیماران آلزایمر و خانواده های آنها امیدوار باشد ، اما باید قبل از استفاده از آن برای معالجه انسان ، چندین دور آزمایش دقیق را پشت سر بگذارد.
محققان خاطرنشان كردند كه هنوز كارهای زیادی برای ترجمه درمان مبتنی بر میکروگلیا به آزمایشات انسانی انجام می شود ، از جمله نشان دادن ایمنی طولانی مدت و ترسیم مسیری به سمت تولید مقیاس پذیر.
اما طبق گفته محققان ، این موانع دوم با تولید میکروگلیا از سلولهای بنیادی خود بیمار می تواند برطرف شود ، که این امر باعث کاهش خطر سیستم ایمنی بدن نیز می شود.
این کار برای درمان انواع دیگر بیماری ها مانند سرطان خون انجام شده است.
به طور متوسط ، می تواند حدود سه تا پنج سال طول بکشد تا درمانی که در موش ها موفق است به آزمایشات انسانی برود.






ارسال پاسخ